2019年年底,北京大学第一医院病理科李挺主任团队与鹍远基因合作,利用鹍远基因OncoAim®肺癌靶向基因检测试剂盒,将NSCLC相关基因突变与融合整合到基于高通量测序(NGS)的单个靶向panel中,以调查相关的基因改变,并评估NGS平台的准确性。该项研究结果发表于Journal of Thoracic Disease杂志上。

论文截图
该研究团队将EGFR突变、ALK重排、ROS1重排以及其他9个重要的肺癌相关基因的改变检测整合到单个NGS平台中,并对107例NSCLC患者的肺癌组织FFPE样本进行了NGS分析。同时,通过免疫组织化学(IHC)染色检测EGFR L858R,EGFR E746-A750Del突变以及ALK和ROS1的基因重排等热点。
这项研究结果显示,与多次IHC染色实验相比,NGS可以探索多种基因突变和基因重排,并且实验时间减少,肿瘤组织量减少。在检测EGFR基因突变中,特别是第19外显子区域,NGS结果比IHC染色更有意义、更可靠。NGS还可以提高ALK重排的阳性率,并减少IHC染色检测到的ROS1重排的假阳性结果。
该研究有何意义?
肺癌是中国乃至全球第一大癌种,每年全球约有176万人死于肺癌,而在国内这一数字是63.1万,每年我国肺癌新发病例达78.7万例,相当于平均每10分钟就有15人罹患肺癌。
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的一种肺癌类型,约占所有肺癌类型的85%,其中超过35%的NSCLC患者有表皮生长因子受体(epidermal growth factor receptor,EGFR)突变,除此之外,还有ALK或ROS1重排等最常见的基因改变。而且,通过RAS-RAF-MEK-MAPK和PI3K-AKT-mTOR通路,EGFR可被KRAS、NRAS、BRAF、ERBB2、RET、MET、FGFR1或PIK3CA的突变激活,从而对TKI(Tyrosine kinase inhibitors,酪氨酸激酶抑制剂)产生耐药性,而TP53失活突变可破坏其关键功能,并与NSCLC不良预后相关,这些基因的突变也对NSCLC的发展与治疗起着重要作用。
随着基因检测技术的快速发展,肺癌诊疗逐渐步入以基因检测指导治疗的“个体化时代”,同时,靶点的选择也越来越精确,什么样的患者适合靶向治疗,要看基因检测的结果,并根据检测结果采用对应的靶向药。
在临床工作中,医生们主要通过直接测序、突变阻滞扩增系统(ARMS)、数字PCR(dPCR)、NGS、免疫组织化学(IHC)等方法检测EGFR突变,并预测癌症患者对EGFR-TKI的反应。
如果想检测上述与NSCLC相关的所有基因改变,更精准地指导靶向药的选择,不光需要大量的肿瘤组织,还需要高通量测序技术(NGS)。虽然高通量测序在基因突变检测中有很大的优势,但是NGS对基因重排的检测敏感性和准确性尚不清楚。
为了解决这些难题,这项研究就此展开。
该研究是如何进行的?
该研究以IHC标准方案,对研究样本的EGFR(L858R和E746-A750del)分子状态、ALK重排、ROS1重排进行了IHC实验。
在DNA文库制备和NGS测序方面,该研究团队对这些癌症样品按照鹍远基因的OncoAim®肺癌靶向基因检测试剂盒推荐的方案,对10个基因(包括ALK,BRAF,ERBB2,EGFR,FGFR1,MET,KRAS,NRAS,PIK3CA和TP53)的所有外显子以及潜在的ALK,ROS1和RET基因重排/融合的探针,进行了靶区域捕获。将两种测序方法两厢对比,再辅以ARMS确认。
该研究的结果为何?
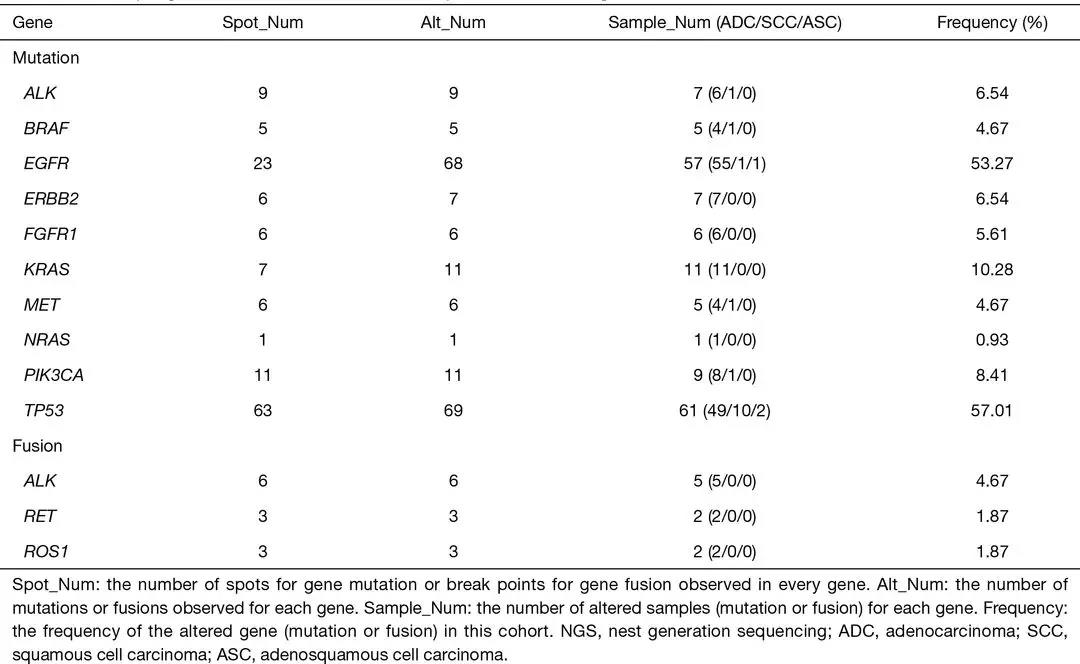
研究团队进行NGS测序,在107个癌症样本中发现了95个样本(88.79%)有DNA变异,包括10个基因相关的193个突变以及3个基因相关的12个基因重排/融合,其中,EGFR基因和TP53基因均显示69个突变,远高于其他基因。
表1 在107个样品中,NGS观察到的基因突变和融合的结果
1.实时PCR(ARMS)证实了NGS的敏感性
为了评估NGS对相关基因改变的敏感性和特异性,研究团队使用ARMS仔细检查了40例EGFR,12例ALK和ROS1的基因状态。在ID 4患者的样本中,ARMS未发现NGS检测的EGFR G719C突变。在ID 5和ID 37患者的样本中,ARMS观察到EGFR G719X突变,却没有区分哪个核苷酸(腺嘌呤、胸腺嘧啶或胞嘧啶)取代了鸟嘌呤,而NGS的结果表明G719X中的鸟嘌呤变成了腺嘌呤(G719A)。同样,ARMS观察到ID 6中EGFR第20外显子区域的插入改变,但NGS更深入地发现了插入的氨基酸序列及其位置,显示为M766MASV。在其他样本中,ARMS在PCR试剂盒范围内检测到的基因突变和融合结果与NGS完全一致。
2.NGS和IHC在EGFR突变热点检测上高度一致
IHC染色的结果表明,EGFR L858R 阳性的样本为23.08%,其中98.46%(64/65)的样本在IHC染色和NGS之间显示出一致的结果。IHC对一个样本阴性,而NGS对该样品阳性,ARMS证实该样品对L858R阳性(样本ID 38)。在65个样本中,有9个样本显示c.2235_2249del或c.2236_2250del改变,在NGS结果中记录为E746_A750del阳性。通过IHC染色,在相同的9个样品也观察到E746_A750del阳性。通过IHC或NGS观察到的其余56个样品呈E746_A750del阴性,显示出这两种方法之间的高度一致性,如表2和图1所示。
表2 IHC和NGS检测EGFR(E746-A750Del,L858R),ALK和ROS1的一致性

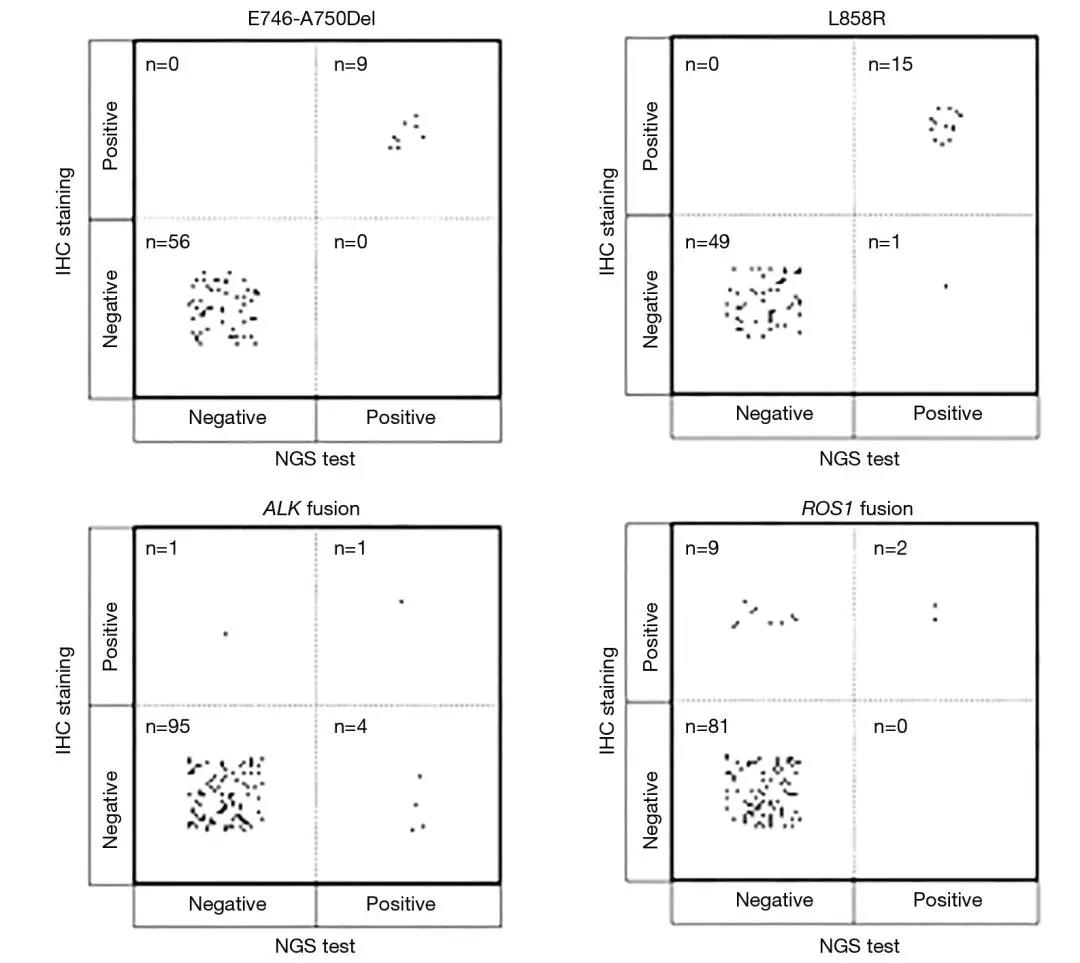
图1 IHC和NGS检测出的EGFR(E746-A750Del,L858R),ALK和ROS1的结果
3.与IHC相比,NGS可发现更多的ALK融合
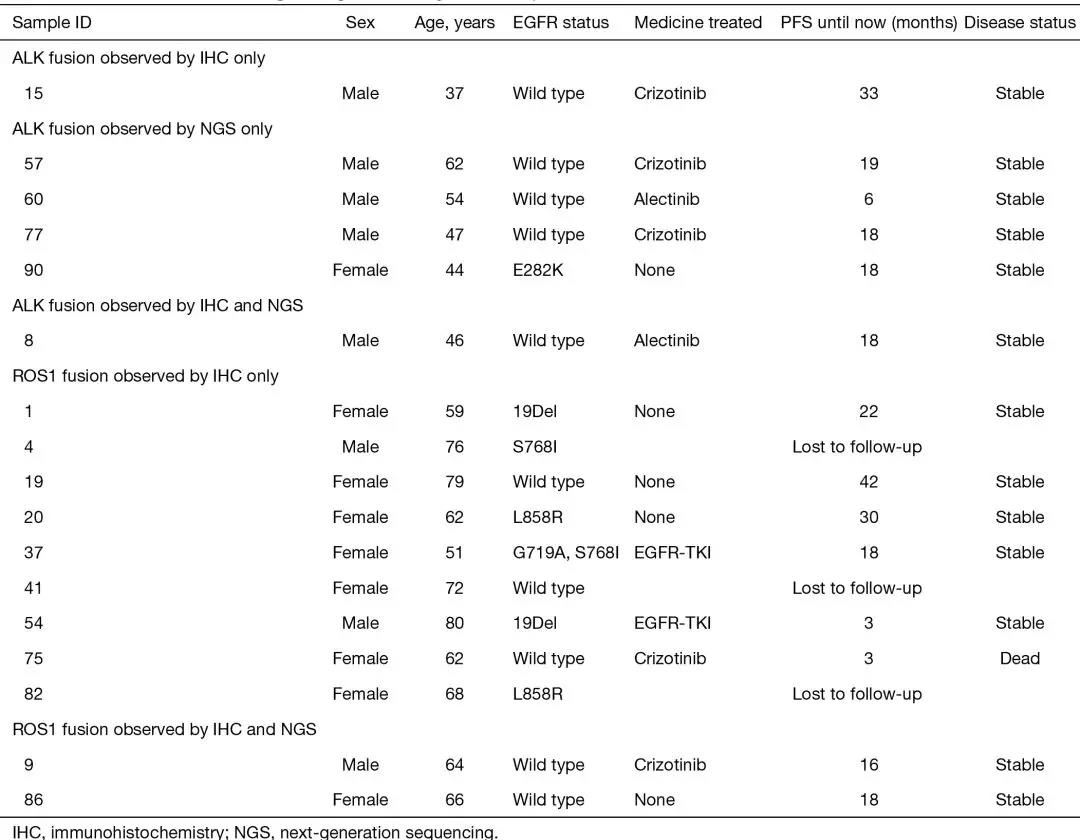
IHC检测发现2例(2/101,1.98%)ALK重排,NGS检出5例(5/101,4.95%)ALK重排。在这些ALK阳性样本中,仅有1例显示IHC和NGS均为阳性结果(图1),该患者在接受艾乐替尼治疗后病情得到稳定控制(表3)。在6例由NGS或IHC发现ALK重排的患者中,有5例在用克唑替尼或艾乐替尼等ALK抑制剂治疗后肿瘤均得到稳定或消退的控制(表3),表明这些ALK重排结果的真实性。这一结果说明,NGS的敏感性(83.33%)远高于IHC的敏感性(33.33%)(表2)。
表3 IHC和/或NGS检测后,基因融合患者的治疗和随访情况汇总
4.NGS可排除IHC检测的ROS1融合假阳性
IHC染色显示ROS1重排11例(11/92,11.96%),NGS只检测出了其中的2例(2/92,2.17%)为阳性。这两位患者病情稳定,其中一个正在接受克唑替尼的治疗。ROS1重排极少与EGFR突变共存,而在仅通过IHC检测显示重排ROS1阳性的9个样本中(表3),通过NGS或ARMS-PCR 证实,有6 个在18~21外显子区域具有EGFR突变,其中2个(患者ID 1和4)通过PCR扩增检测被证明为ROS1重排阴性。其他三名患者,其中一名失去随访,一名仍存活下来,但随访时间很短;最后一名在经过最初诊断后的3个月内进行了克唑替尼治疗,但很快死亡(表3)。该结果提示,仅由IHC检测到的ROS1重排是可疑的。基于该结果,在检测ROS1重排方面, IHC的特异性(90%)略低于NGS(100%)(见表2)。
该研究有何启示?
在这项研究中,只对50ng DNA的微量样本进行NGS检测,就发现了NSCLC中常见的突变,而且还包括3个药物融合基因,即ROS1、ALK和RET。此外,ARMS和NGS观测的结果有很高的一致性,但NGS揭示了更详细的信息,表明本研究所采用的NGS检测具有很高的可靠性。与IHC染色相比,NGS可以提供比EGFR基因改变更多的信息和可靠的结果。在基因融合检测方面,与IHC染色相比,NGS可提高ALK的阳性率,并降低ROS1的假阳性结果。
因此,研究团队认为, NGS平台可以检测到各种基因突变和基因重排,显示出高性能和高成本效益。与此同时,他们建议,在仅通过IHC观察到ALK阴性和/或ROS1阳性的样本中,有必要进行其他分析(如NGS)进行确认。
肿瘤分子精准靶向治疗为越来越多的癌症患者看到了生命的光亮,而有效靶向药与癌症之间的沟壑需要伴随诊断技术这一桥梁。鹍远基因一直致力于基因诊断技术的研发,拥有丰富的产品管线,能帮助临床医生快速、准确找到癌症特定靶点,在癌症治疗和临床科研方面都能成为广大医生的最佳合作伙伴,用最前沿的科技造福千千万万的肿瘤患者和家庭。
资料来源:
[1]http://jtd.amegroups.com/article/view/33978/html
[2]Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6): 394-424.
[3]郑荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19-28.
[4]中国医师协会肿瘤医师分会,中国抗癌协会肿瘤临床化疗专业委员会.中国表皮生长因子受体基因敏感性突变和间变淋巴瘤激酶融合基因阳性非小细胞肺癌诊断治疗指南(2015版)[J].中华肿瘤杂志,2015,(10):796-799.









