
ESMO 2020,鹍远基因以poster的形式公布了与国内多家顶级三甲医院和知名临床专家合作的3项癌症早筛早诊最新研究成果,内容基于鹍远基因的专利ctDNA甲基化检测技术,涉及肺癌、甲状腺癌、胰腺癌等多个我国常见癌症的早筛早诊临床研究,技术性能居于全球领先水平。
一、ESMO 2020 鹍远基因早筛新进展之肺癌:ctDNA甲基化标记物可用于肺癌精准早筛
鹍远基因与四川大学华西医院、复旦大学附属肿瘤医院合作,在ESMO 2020年会上发布了“Identification and validation of circulating tumor DNA methylation markers for lung nodule stratification(ctDNA甲基化标记物在肺癌早期检测中的应用)”专题壁报。
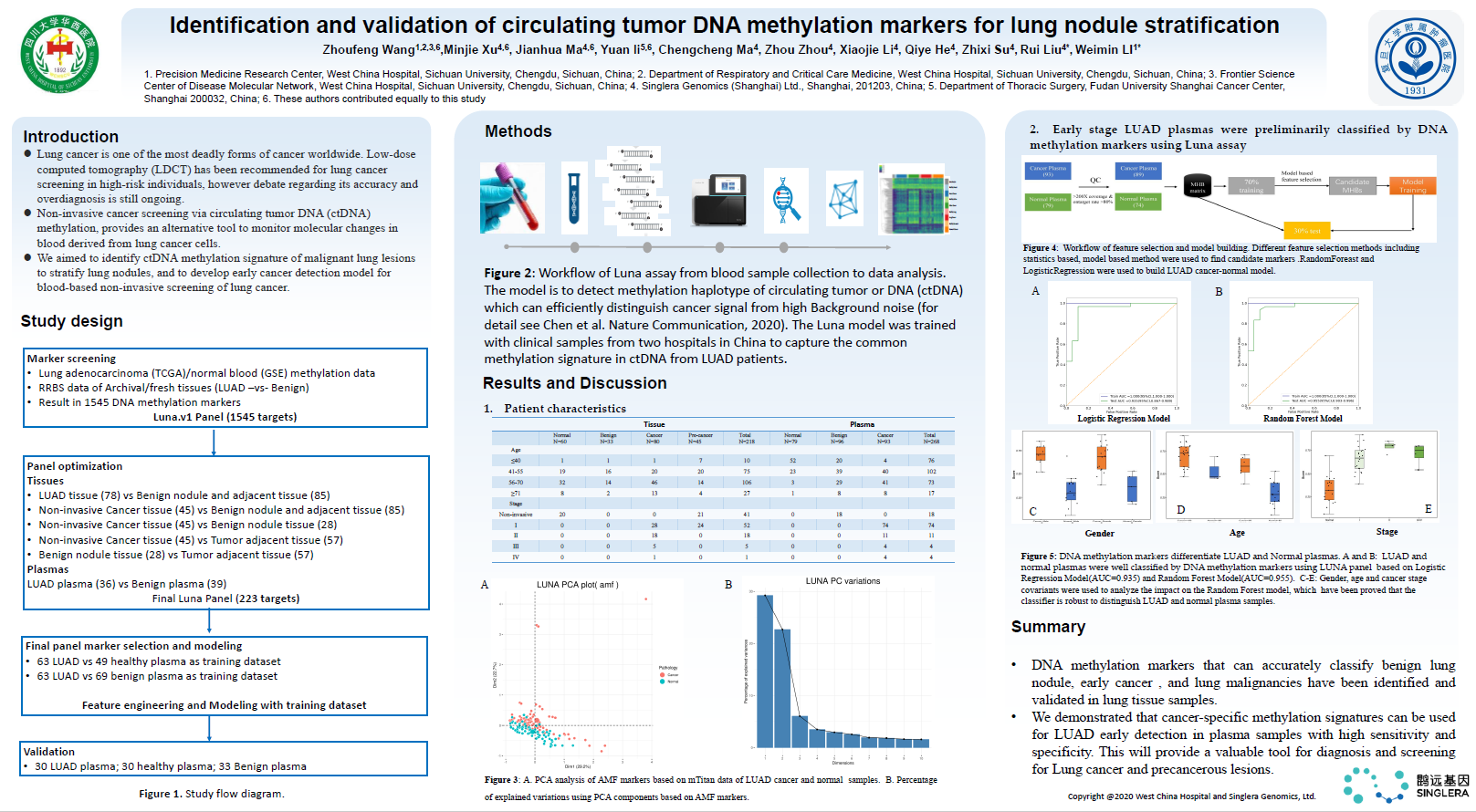
这项研究通过层层筛选、机器学习建模,开发了基于ctDNA甲基化液体活检的Luna分析方法,能通过组织样本准确区分良性肺结节、肺癌(尤其是早期肺癌)。该研究表明,血浆中的癌症特异性甲基化特征可用于肺腺癌的早期检测,且具有较高的敏感性和特异性,可为肺癌和癌前病变提供有价值的诊断和筛查方式。
这项研究共入组了486例样本,包括肺组织样本218例(健康人肺组织60例,良性肺结节33例,浸润性肺癌80例,非浸润性肺癌45例)和血浆样本268例(健康受试者血浆样本79例,肺良性结节患者血浆96例,肺癌患者血浆93例)。研究人员首先对各种类型的肺组织样本和血浆样本进行对比筛选,从1545个DNA甲基化标志物中确定了223个最具肺癌特异性的DNA甲基化标记物,建立了Luna分析模型。
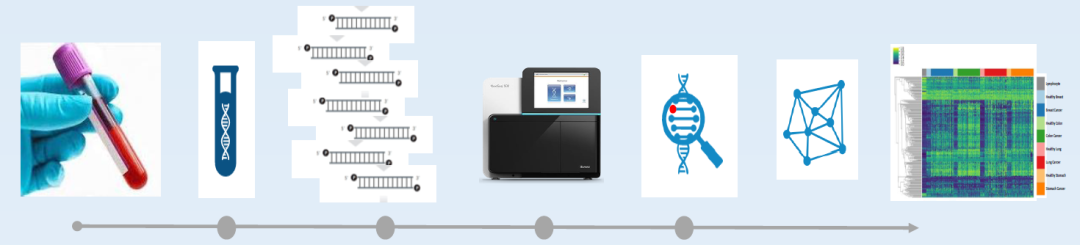
图1 Luna分析模型从血样采集到数据分析的工作流程
Luna模型基于四川大学华西医院、复旦大学附属肿瘤医院2家国内顶级三甲医院的临床样本进行训练,以捕捉肺腺癌(LUAD)患者ctDNA中常见的甲基化特征。该模型使用的ctDNA甲基化单倍型技术,可以有效地将癌症信号与高背景噪声区分开来,解决了血浆样本中ctDNA甲基化信号弱、难发现的问题。
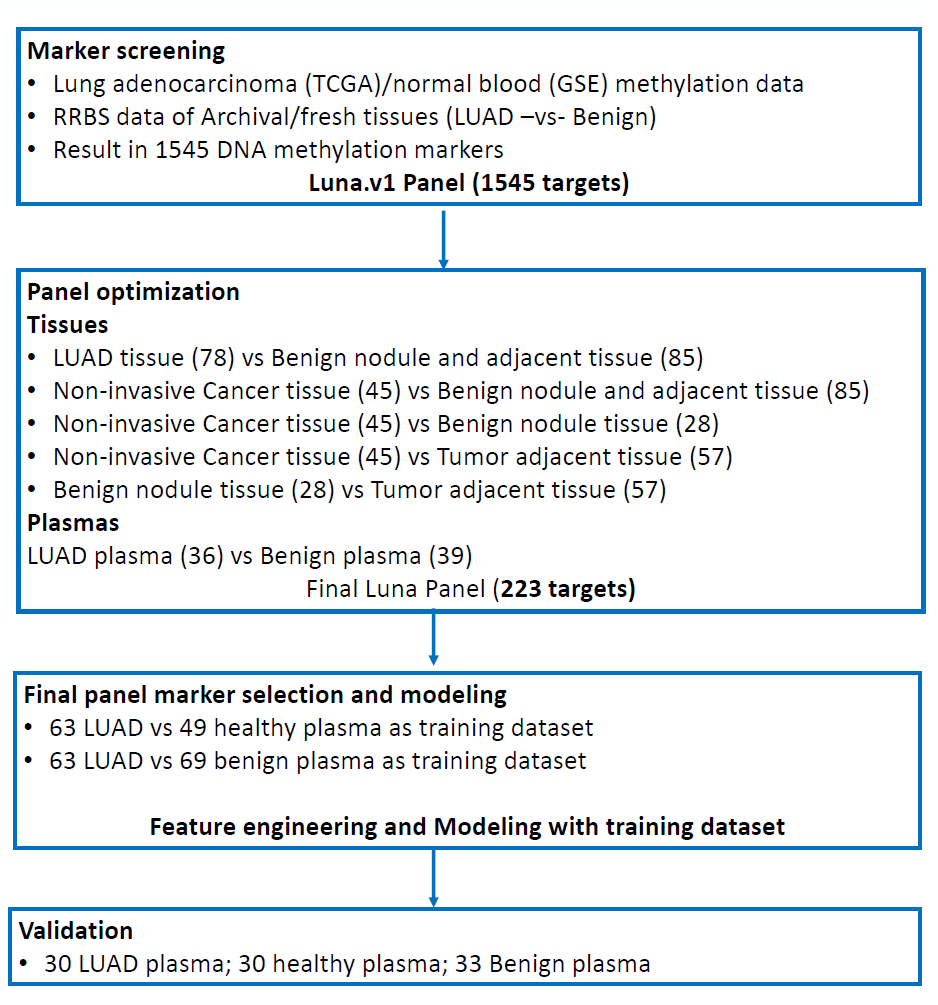
图2 研究流程图
最后,为了验证Luna分析能通过血浆中的DNA甲基化标志物准确识别早期肺腺癌,研究人员选取了63名肺腺癌受试者的血浆和49名健康受试者的血浆,构建训练集,以寻找候选DNA甲基化标志物,构建肺腺癌-正常血浆模型,最后在独立测试样本中进行验证(30名肺腺癌,30名健康受试者)。最终,构建了Logistic回归和随机森林模型,Luna分析在测试集中的AUC分别为0.935(95%CI:0.867~0.989)和0.955(95%CI:0.903~0.966),如图3A、B所示,这表明Luna panel中包含的DNA甲基化标记物能通过血浆样本精准区分肺腺癌患者和健康受试者。此外,该研究还发现,在不同性别、年龄层和肺癌分期受试者中,Luna分析均能获得与各亚组相匹配的、稳定的检测值区间,这说明Luna分析不受性别和年龄的影响,能通过血浆检测准确区分肺腺癌患者和健康人,且Luna分析鉴别早期肺癌患者和健康人的准确性较高,具备用于肺癌早筛的潜质,如图3C、D、E所示。
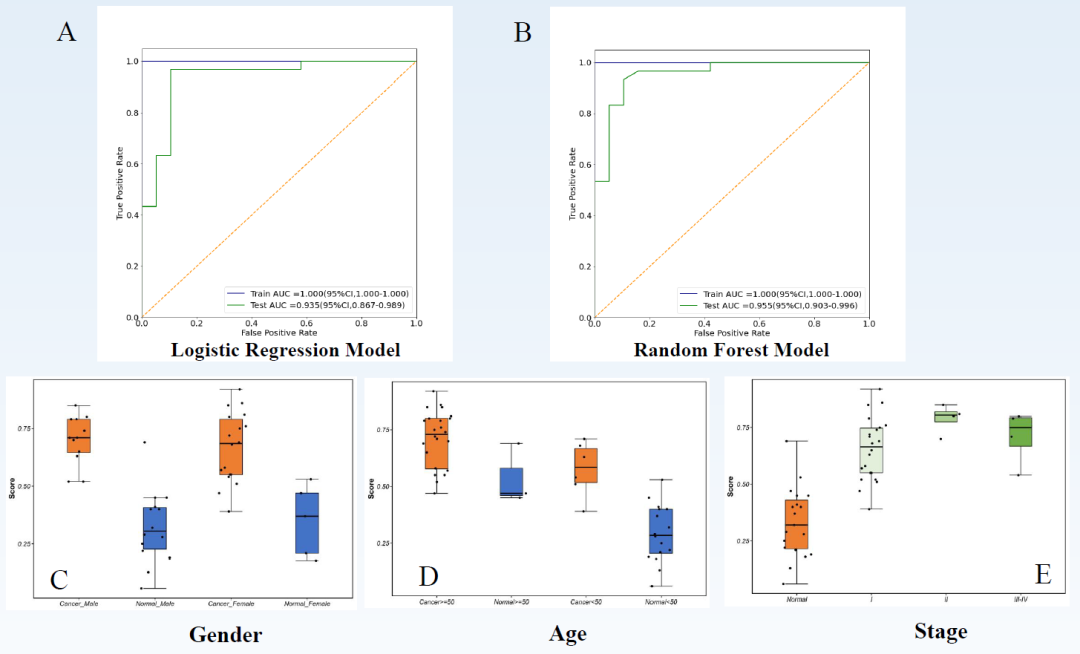
图3 DNA甲基化标记物通过血浆区分LUAD患者和健康人
资料来源:
https://cslide.ctimeetingtech.com/esmo2020/attendee/confcal_2/presentation/list?q=Identification+and+validation+of+circulating+tumour+DNA+methylation+markers+for+lung+nodule+stratification
二、ESMO 2020 鹍远基因早筛新进展之甲状腺癌:血液中的新DNA甲基化标志物被找到,可用于甲状腺结节良恶性鉴别
在ESMO 2020年会上,鹍远基因与中山大学附属第一医院合作发布了“Discovery and validation of novel DNA methylation markers for thyroid nodule diagnostics in plasma(血液新DNA甲基化标记物在甲状腺结节诊断中的应用)”主题壁报。

该研究采用鹍远基因拥有自主专利的MONOD+及mTitan方法,建立了几种诊断模型,使用机器学习方法对甲状腺结节进行分类。研究团队用甲基化单倍型负荷(MHL)和甲基化单倍型频率(MHF)来表示甲基化单倍域(MHB)中的DNA甲基化水平,确定了>100个甲状腺乳头癌(PTC)特异性的DNA甲基化标记,并以深度测序来提高检测覆盖率和信噪比。
基于甲状腺结节患者组织样本和血浆样本的靶向甲基化测序和实时PCR检测结果,确定了适用于组织样本的ThyC-1 Panel和适用于血液样本的ThyC-2 Panel。
留一法交叉验证结果表明,利用ThyC-1 Panel检测PTC和甲状腺良性结节(BTN)组织样本,SVM模型的平均AUC为0.97,ACC为0.88,如下图4所示,其准确性与KNN、LDA、随机森林、RegLogistic等经典机器学习方法相似,说明了ThyC-1 Panel中的DNA甲基化标记物鉴别甲状腺结节良恶性组织的准确性极高。
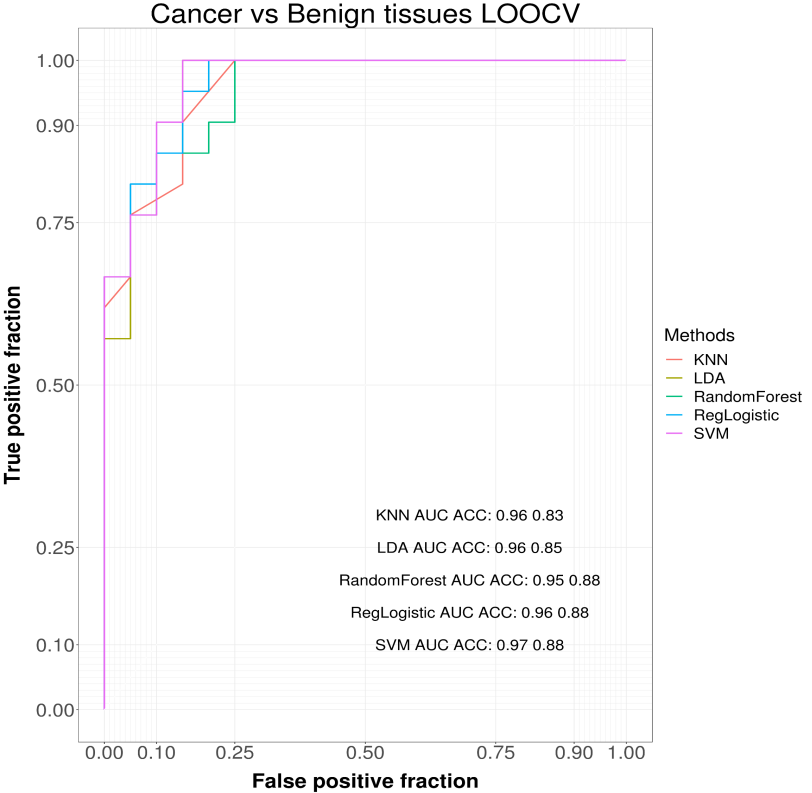
图4 DNA甲基化标记物在组织样本中的准确性
在血浆样本检测方面,来自112例PTC患者和96例BTN患者的血浆,被分为训练集与测试集。ThyC-2 Panel中的DNA甲基化标志物在训练集训练后,再用测试集进行了验证,最终结果显示ThyC-2 Panel在测试集中的平均AUC为0.786(95%CI:0.700~0.859),如图5所示。这一结果说明,血浆中的DNA甲基化标记物可以较好地鉴别甲状腺结节的良恶性,有望开发成为甲状腺癌早期辅助诊断的非侵入性检测方法。
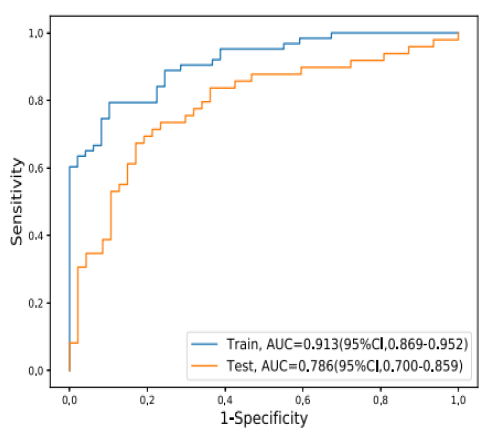
图5 DNA甲基化标记物在血浆样本中的准确性
资料来源:
https://cslide.ctimeetingtech.com/esmo2020/attendee/confcal_2/presentation/list?q=Discovery+and+validation+of+novel+DNA+methylation+markers+for+thyroid+nodule+diagnostics+in+plasma
三、ESMO 2020 鹍远基因早筛新进展之胰腺癌:cfDNA甲基化靶向测序,破解胰腺导管腺癌致命难题
在2020 ESMO年会上,鹍远基因与北京协和医院、上海长海医院合作发布了“Early detection of pancreatic ductal adenocarcinoma (PDAC) using methylation signatures in circulating tumor DNA【ctDNA甲基化特征在胰腺导管腺癌(PDAC)早期检测中的应用】”主题壁报。
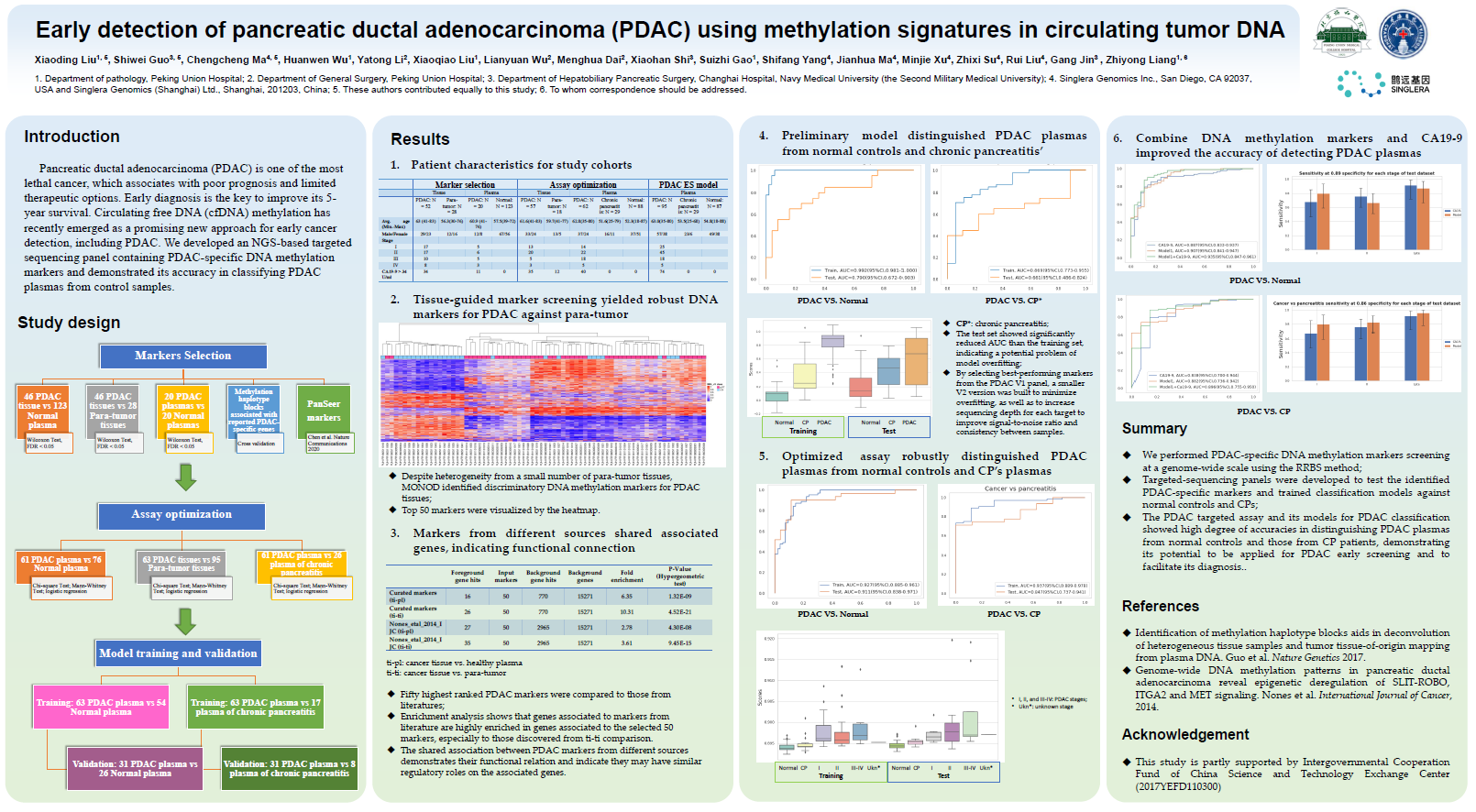
该研究基于NGS技术,开发了一个含有PDAC特异性DNA甲基化标记物的靶向测序Panel,并证明了这一Panel能通过检测血浆样本准确识别PDAC。
该研究利用鹍远基因拥有自主专利的MONOD分析技术,从PDAC组织样本和癌旁组织样本中识别出了具有PDAC特异性的DNA甲基化标记物,形成了PDAC V1 Panel。在去年的ESMO年会上,鹍远基因已公布了既往已发表标记物相关的基因在该研究标记相关的基因中高度富集,表明它们可能共同调节与PDAC病理相关的同一组基因。
今年,研究团队从去年发表的PDAC V1 Panel中选择了性能最好的标记物,构建了PDAC V2 panel,并增加每个目标的测序深度,大大提高了信噪比和样本之间的一致性。优化后的检测方法能通过血浆样本有效区分PDAC患者、正常对照人群和慢性胰腺炎(CP)患者,如图6所示,在测试集中鉴别PDAC与正常对照人群,该检测方法的平均AUC为0.911(95%CI:0.838~0.971);在测试集中鉴别PDAC与CP,其平均AUC为0.847(95%CI:0.737~0.941)。
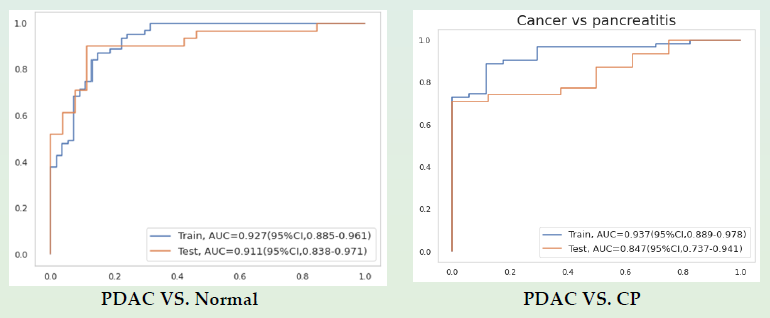
图6 cfDNA甲基化标志物区分PDAC、正常对照人群和CP的准确性
从图7 可知,用该检测方法和机器学习算法,在训练集和测试集中正常对照血浆、CP血浆和各期均可以得到相对应的、相对稳定的检测分数。由此可见,利用cfDNA甲基化标志物检测,可以高度准确地区分PDAC、正常对照人群和CP,而且cfDNA甲基化标志物用于PDAC早期检测具有可行性。
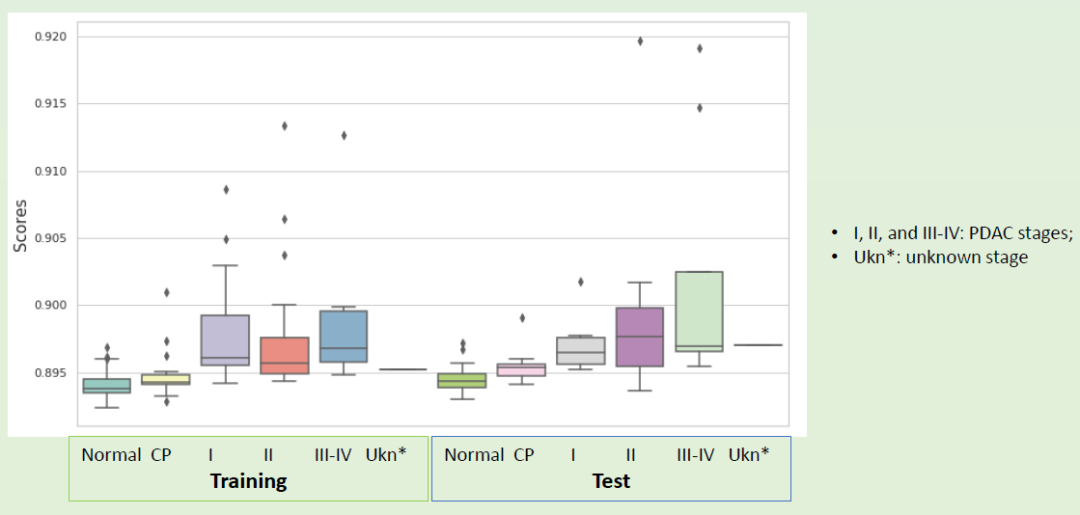
图7 cfDNA甲基化标志物区分正常对照人群、CP和 不同阶段PDAC的准确性
该研究进一步比较了cfDNA甲基化标志物与肿瘤标志物CA19-9通过血浆检测识别PDAC的准确性,如图8所示,在PDAC与正常对照组、CP的鉴别中,cfDNA甲基化标志物的准确性均要优于肿瘤标志物CA19-9(AUC:0.907 vs 0.887,0.882 vs 0.838),而cfDNA甲基化标记物与CA19-9联合应用可提高PDAC血浆检测的准确性,AUC分别为0.935和0.896。
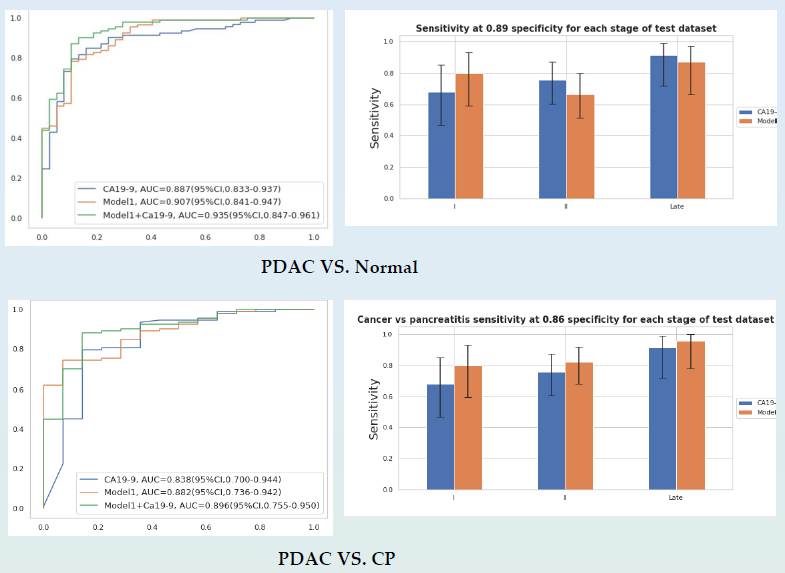
图8 cfDNA甲基化标志物与肿瘤标志物CA19-9鉴别PDAC准确性的比较
在PDAC与正常对照组的测试集中,检测特异性为0.89时,cfDNA甲基化标志物在I期 PDAC中的灵敏度要优于CA19-9。在PDAC与CP的测试集中,检测特异性为0.86时,cfDNA甲基化标志物的灵敏度在PDAC各阶段中都要优于CA19-9。这说明,cfDNA甲基化标志物比肿瘤标志物CA19-9更适宜用于PDAC的早期检测。
总而言之,鹍远基因使用RRBS方法在全基因组范围内筛选出了PDAC特异性DNA甲基化标记物,由此构建的PDAC靶向检测及其PDAC分类模型能利用血浆样本,将PDAC血浆从非恶性疾病中识别,显示了其应用于PDAC早期筛查和促进PDAC早期诊断的潜力。
资料来源:
https://cslide.ctimeetingtech.com/esmo2020/attendee/confcal_2/presentation/list?q=Early+detection+of+pancreatic+ductal+adenocarcinoma+%28PDAC%29+using+methylation+signatures+in+circulating+tumour+DNA







