近期国际临床转化期刊Clinical and Translational Medicine(IF 10.6)上刊载了由复旦大学附属中山医院樊嘉院士、周俭教授和杨欣荣教授团队、联合鹍远生物、福建医科大学孟超肝胆医院刘小龙教授团队等的重要研究成果[1]:“Early detection and prognosis evaluation for hepatocellular carcinoma by circulating tumour DNA methylation: A multicenter cohort study(通过循环肿瘤DNA甲基化对肝细胞癌进行早期检测与预后评估的多中心队列研究)”。该研究系2019年复旦大学附属中山医院牵头,联合鹍远生物等多家单位共同申报的“国家重点研发计划-重大慢性非传染性疾病防控研究专项:基于液体活检技术的常见恶性肿瘤筛查及早诊技术研发与评价研究”的系列研究成果之一。
原发性肝癌在所有癌症的死亡率中高居中国第二位、全球第三位[2],其中肝细胞癌(HCC)约占80%[3]。目前肝癌的发病率和死亡率仍在不断上升,导致全球公共卫生负担沉重[4]。早诊早治在进一步提升肝癌总体疗效中作用关键[5-8]。目前用于HCC诊断的策略,无论是血清甲胎蛋白(AFP)还是超声,都缺乏足够的灵敏度和特异性,尤其是对于早期HCC[9, 10]。因此,亟需研发高灵敏度、高特异性、经济有效的诊断工具,以进一步改善HCC患者的总体预后。
本研究通过对HCC的癌与癌旁进行了全基因组甲基化检测,鉴定出HCC的差异性甲基化区域(differentially methylated region,DMR),进一步从中筛选出效果最好的二十个DMRs,并将其纳入多位点qMSP检测模型(HepaAiQ)中。HepaAiQ模型经过训练,能够将293名HCC患者(BCLC 0/A期,224例)与266名对照组区分,包括慢性乙型肝炎(CHB)、肝硬化(LC)、良性肝病变(BHL)和健康对照(HC)。该模型在HCC中的灵敏度为86.0%,在对照组中的特异度为92.1%,曲线下面积(AUC)为0.944;进一步在523名的验证队列中进行验证,HepaAiQ模型的AUC为0.940,在205例HCC病例中的灵敏度为84.4%(BCLC 0/A期,167例),在318名对照中的特异度为90.3%。在另一个早期肝癌的独立测试集中评估时,HepaAiQ模型在65例BCLC 0/A期(44例0期,21例A期)的HCC患者中显示了70.8%的灵敏度,对于124例CHB/LC患者的特异度为89.5%。此外,对103例HCC患者的术前和术后血浆样本进行了HepaAiQ模型评估,并与患者2年的预后结果相关联,我们发现术后HepaAiQ评分高的患者显示出更高的复发风险(风险比HR=3.33,P<0.001)
「研究设计」
该研究设计了三个阶段(图1):标记物的发现与优化,HepaAiQ模型构建与验证,以及临床应用。
第一阶段:标记物的发现与优化。首先,基于RRBS和TCGA数据库,筛选排名靠前的DMRs,并使用HCC癌和癌旁,白细胞进行qMSP验证,对表现最佳的20个标记进行了优化。基于这些标记开发了基于血液的多位点qMSP检测方法HepaAiQ。
第二阶段:HepaAiQ模型与构建。在559名患者中(293例HCC(早期占比76.5%),266例对照组)建立了用于早期HCC检测的HepaAiQ模型,并在一个独立的523名患者队列中进行了验证。
第三阶段:HepaAiQ的临床运用,将HepaAiQ模型应用与现有血清检测方法的比较,早期肝癌的独立测试集和手术切除病人中的进行验证。
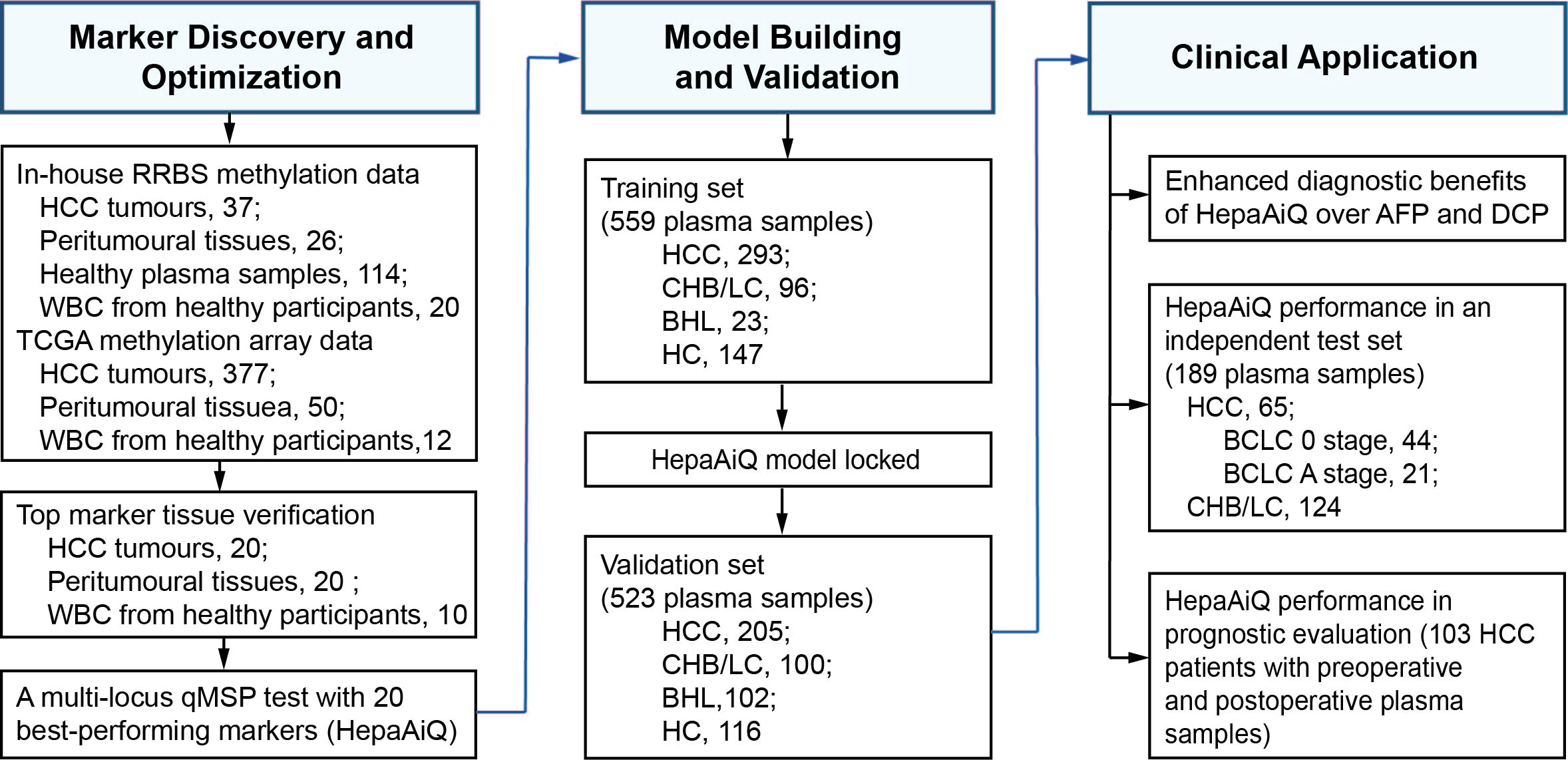
图1 研究设计
「结果」
在RRBS和TCGA数据分析时,我们通过HCC癌与癌旁或健康血浆的三次独立比较,根据采用的p值、甲基化分位数和CG富集程度对HCC组织中高度代表性的DMRs进行了排序,以滤除背景噪声较高的标记物。最后,与所有其他对照相比,我们在癌症样本中发现了183个常见的高甲基化DMRs。我们用qMSP筛选并验证了20个最有效的标记,并将其纳入多位点qMSP分析,形成HepaAiQ模型。
为建立HCC诊断的HepaAiQ模型,训练集纳入了293名HCC患者、96名CHB/LC患者、23名BHL患者和147健康对照,其中BCLC 0/A期(CNLC I期)HCC患者的比例高达76.5%。所得HepaAiQ模型的AUC为0.944(图2),对应于HCC的敏感性为86.0%,CHB/LC、BHL和HC的特异性分别为90.6%、100%和91.8%。验证集纳入了523例患者,其中HCC患者含81.5%的早期HCC。验证集中HepaAiQ的AUC为0.940,HCC的灵敏度分别为84.4%,CHB/LC、BHL和HC的特异性分别为88.0%、92.2%和90.5%。值得注意的是,在训练集和验证集中,HepaAiQ模型对早期HCC的敏感性分别为83.0% / 80.8%,对小于2 cm的肿瘤的敏感性分别为75.6% / 77.8%,对单个肿瘤的敏感性分别为83.9% / 82.9%。结果表明HepaAiQ模型在HCC早期检测和鉴别诊断中具有强大的应用潜力。
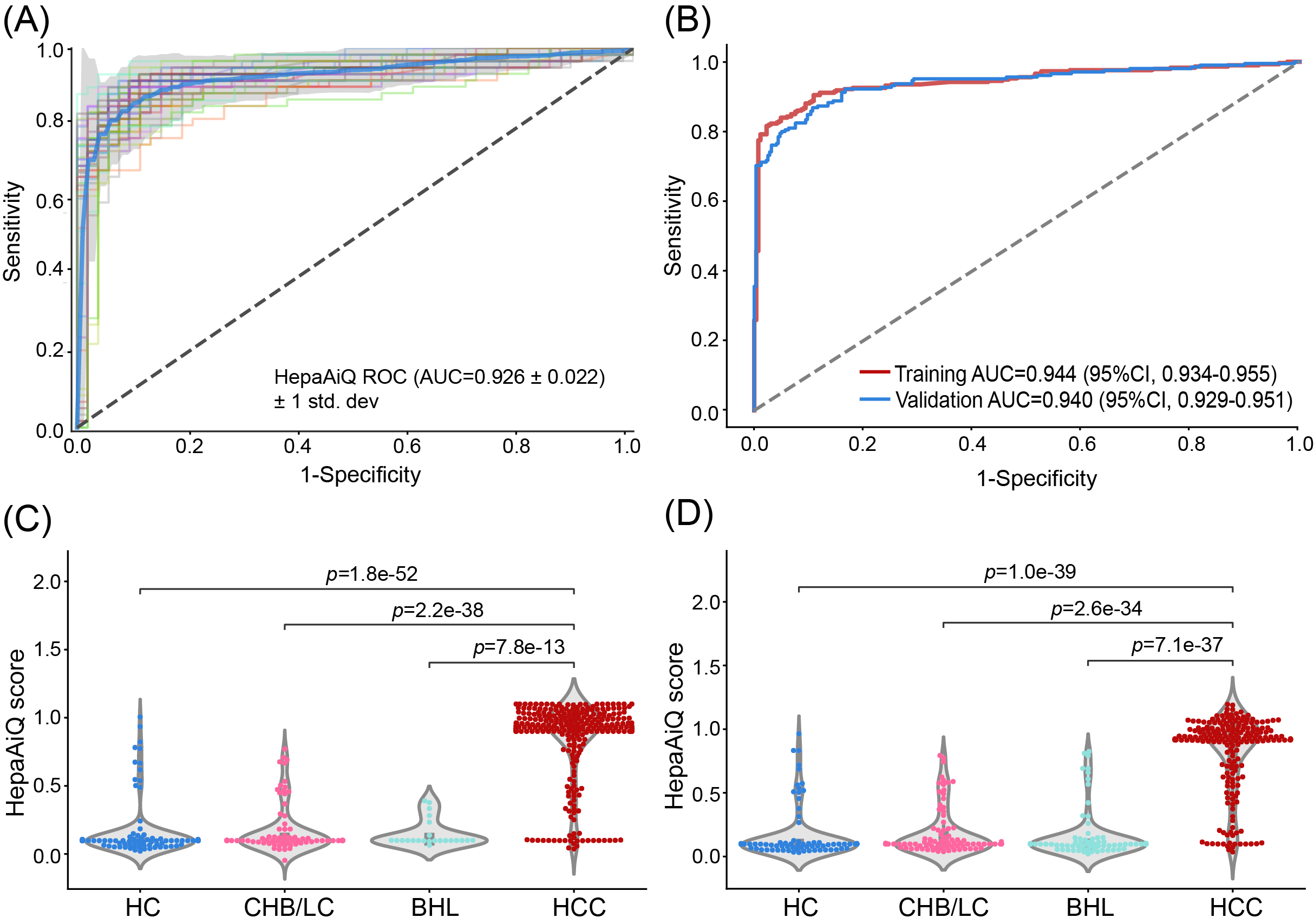
图2. HepaAiQ模型的训练和验证。
研究系统对比了HepaAiQ模型是否比现有的HCC血液检测更有优势。在489名HCC患者中,HepaAiQ的性能显著优于AFP(85.3% vs. 55%)(图3),在247名对照组中显示了相当的特异性。值得注意的是,在189名AFP结果为阴性的早期HCC患者中,HepaAiQ的敏感性为75.1%。类似地,HepaAiQ在441名患者中的性能也优于DCP。这些结果表明甲基化标记物能准确捕获HCC信号,能够提高临床监测的有效性。
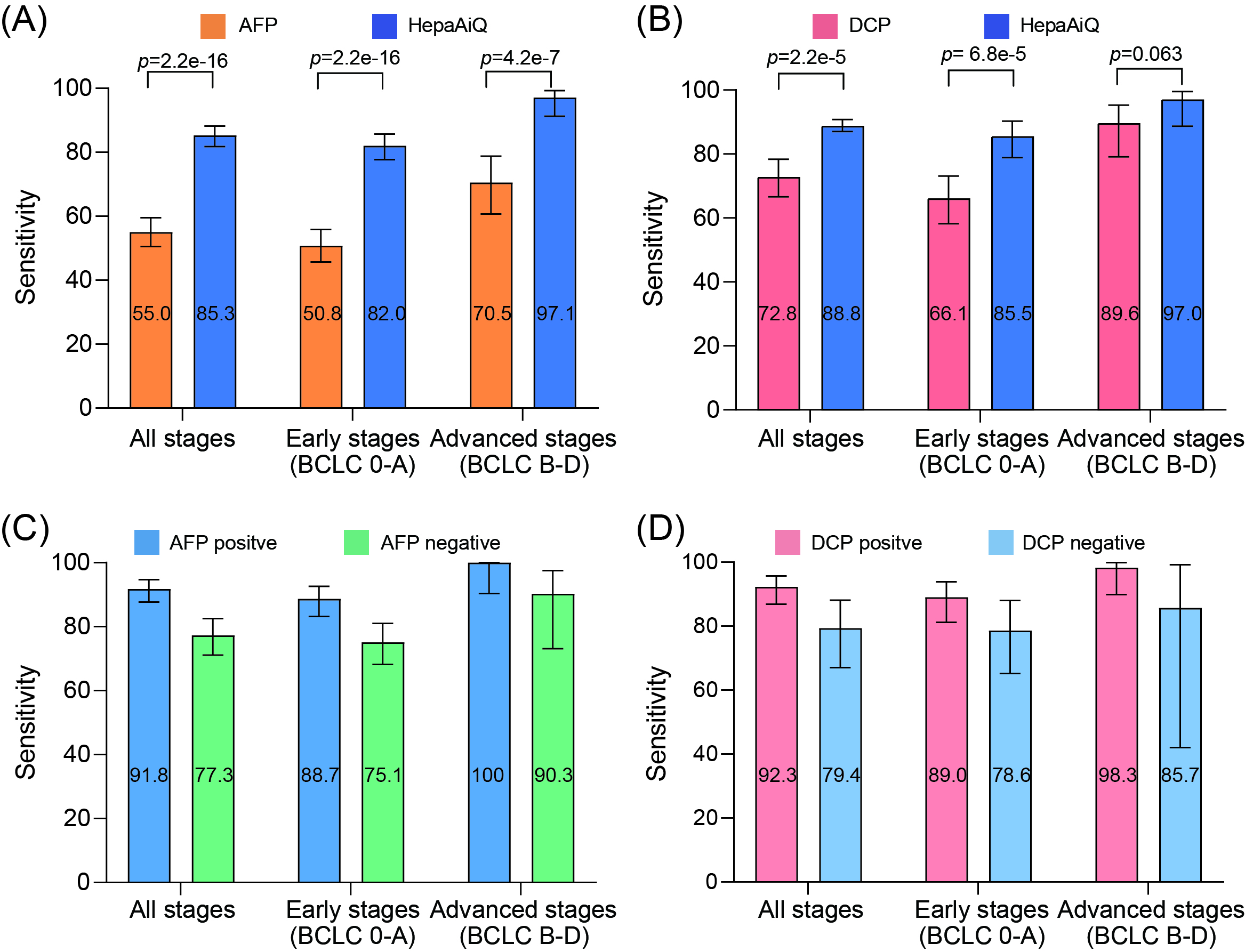
图3. HepaAiQ、AFP和DCP检测HCC的性能比较。
单独采集并进行检测分析的独立测试集结果显示,HepaAiQ对高风险人群中早期HCC的敏感性为70.8%,特异性为89.5%,显示出早期HCC筛查的潜在应用前景。
此外,本研究还纳入了103名接受HCC切除手术患者进行预后评估(图4)。结果表明:术后随访中,47例出现复发,56例未复发;和术前相比,术后一个月HepaAiQ法检测到的ctDNA甲基化水平显著下降,阳性率从78.6%下降至33.0%;Kaplan-Meier生存分析表明,术后ctDNA阳性患者预后较差,复发率显著增高(HR=3.33;95% CI:1.87-5.92,p < 0.001);多因素分析证实术后ctDNA阳性状态是预测术后复发的独立预后指标。
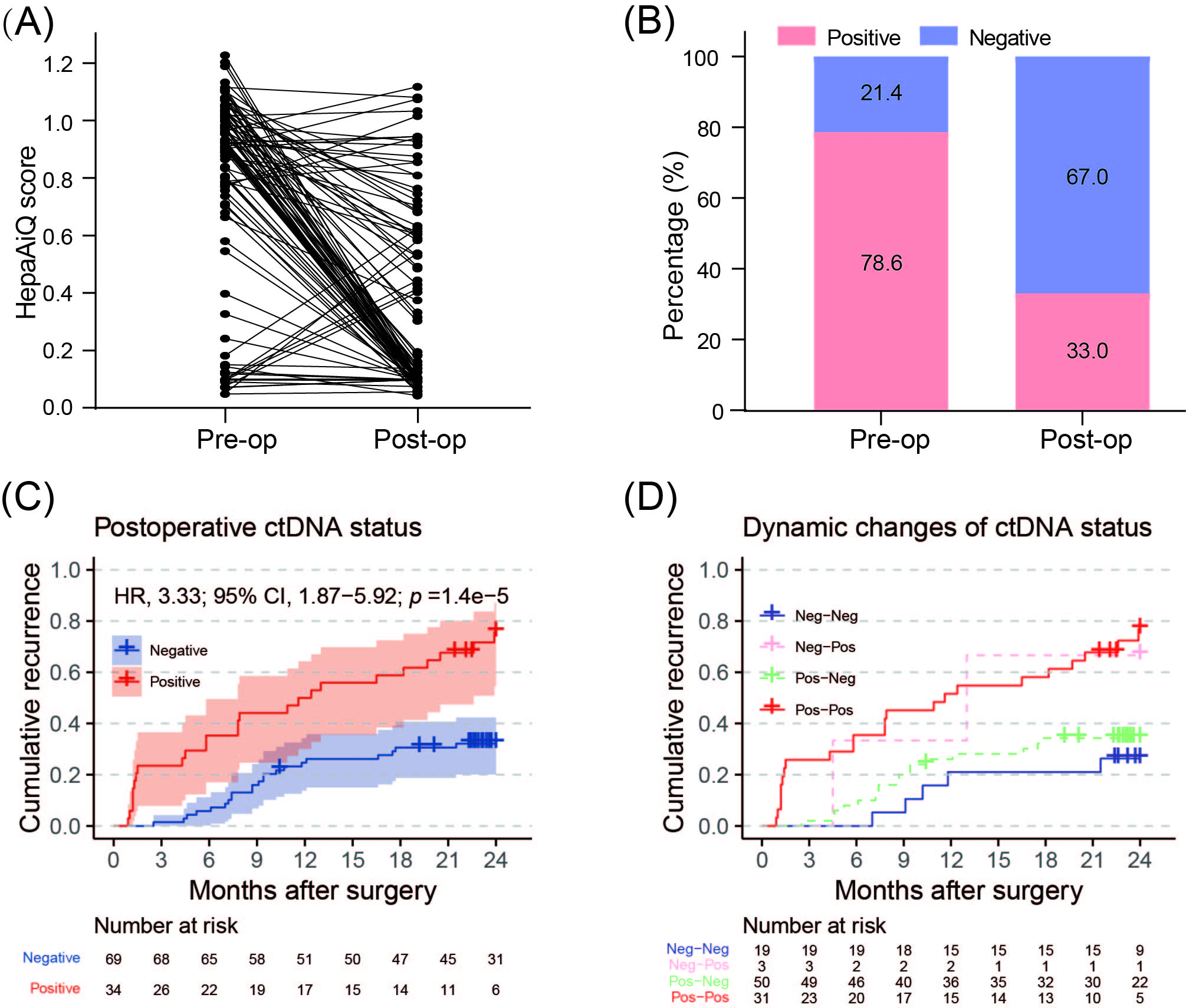
图4. HepaAiQ模型的预后评价。
「小结」
本研究研发出一种经济实惠、易于操作的多基因qMSP检测(HepaAiQ模型),发现了一种新型的血浆ctDNA甲基化模式,用于HCC的早期诊断和患者预后评估。HCC患者血浆的特定ctDNA甲基化模式在HCC的早期检测中性能出色,特异性和灵敏度均高于AFP和DCP。这种ctDNA检测方法可有助于进一步提升HCC患者早期诊断,并且可能为预防性筛查和疗效监控提供了一个更便捷的监测工具。
「参考文献」
[1] Guo, D.-Z., et al., Early detection and prognosis evaluation for hepatocellular carcinoma by circulating tumour DNA methylation: A multicentre cohort study. Clinical and Translational Medicine, 2024. 14(5): p. e1652.
[2] Sung, H., et al., Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin, 2021. 71(3): p. 209-249.
[3] Singal, A.G., P. Lampertico, and P. Nahon, Epidemiology and surveillance for hepatocellular carcinoma: New trends. J Hepatol, 2020. 72(2): p. 250-261.
[4] Younossi, Z.M., et al., The Global Burden of Liver Disease. Clinical Gastroenterology and Hepatology, 2023.
[5] European Association for the Study of the Liver. Electronic address, e.e.e. and L. European Association for the Study of the, EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol, 2018. 69(1): p. 182-236.
[6] Singal, A.G., et al., International Liver Cancer Association (ILCA) White Paper on Biomarker Development for Hepatocellular Carcinoma. Gastroenterology, 2021. 160(7): p. 2572-2584.
[7] Yang, J.D., et al., A global view of hepatocellular carcinoma: trends, risk, prevention and management. Nature reviews Gastroenterology & hepatology, 2019. 16(10): p. 589-604.
[8] Kanwal, F. and A.G. Singal, Surveillance for Hepatocellular Carcinoma: Current Best Practice and Future Direction. Gastroenterology, 2019. 157(1): p. 54-64.
[9] Luo, P., et al., A Large-scale, multicenter serum metabolite biomarker identification study for the early detection of hepatocellular carcinoma. Hepatology, 2018. 67(2): p. 662-675.
[10] Simmons, O., et al., Predictors of adequate ultrasound quality for hepatocellular carcinoma surveillance in patients with cirrhosis. Aliment Pharmacol Ther, 2017. 45(1): p. 169-177.








